พันธะเคมี
พันธะภายในโมเลกุล
(intramolecular bond) |
พันธะระหว่างโมเลกุล
(intermolecular bond) |
พันธะโคเวเลนต์ (covalent bonds)
|
พันธะไฮโดรเจน (hydrogen bonds)
|
พันธะไอออนิก (ionic bonds)
|
แรงแวนเดอร์วาลส์ (Van der Waals forces)
|
พันธะโลหะ ( metallic bonds)
|
แรงดึงดูดระหว่างโมเลกุล - ไอออน
(molecule-ion attractions) |
3.1 สัญลักษณ์แบบจุดของลิวอิสและกฎออกเตต
สัญลักษณ์แบบจุดของลิวอิส

กฎออกเตด (Octet rule)
จากการศึกษาเกี่ยวกับธาตุก๊าซเฉื่อย เช่น He Ne Ar Kr พบว่าเป็นธาตุที่โมเลกุลเป็นอะตอมเดี่ยว คือในหนึ่งโมเลกุลของก๊าซเฉื่อยจะมีเพียง 1 อะตอม แสดงว่าเป็นธาตุที่เสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือมี 8 อิเล็กตรอน(ยกเว้น He มี 2 อิเล็กตรอน) เช่น
2He =210Ne = 2 ,818Ar = 2 , 8 ,836Kr = 2 , 8 , 18 ,8
ส่วนธาตุหมู่อื่นมีการจัดเรียงอิเล็กตรอนในระดับพลังงานชั้นนอกสุด ไม่ครบ 8 เช่น
1H =16C = 2 ,47N = 2 ,58O = 2 ,6
ธาตุที่มีวาเลนต์อิเล็กตรอนไม่ครบ 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยวๆได้ ซึ่งแสดงว่าไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า
3.2 พันธะไออนิก
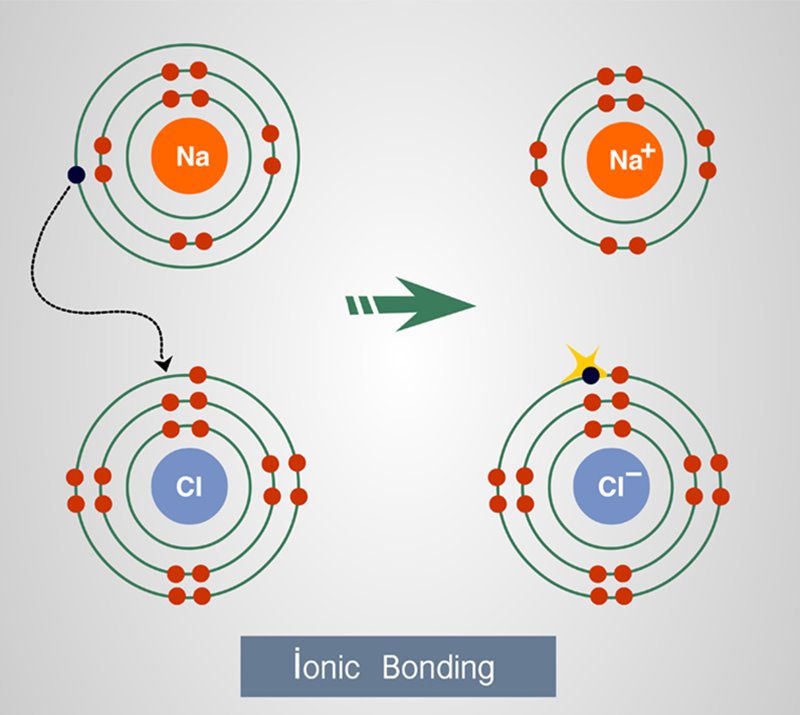
เป็นพันธะที่เกิดขึ้นระหว่างอะตอมซึ่งมีประจุตรงข้ามกัน และดึงดูดเข้าหากันจากการเคลื่อนย้ายอิเล็กตรอนหนึ่งตัวหรือมากกว่า จำนวนอิเล็กตรอนซึ่งอยู่วงนอกสุดของอะตอมหนึ่งไปอยู่ร่วมกับกลุ่มอิเล็กตรอนวงนอกสุดของอีกหนึ่งอะตอม เพื่อให้จำนวนอิเล็กตรอนวงนอกสุดของทั้งสองอะตอมครบออกเตต (Octet)
การจับคู่พันธะแบบไอออนิกนี้เกิดขึ้นระหว่างอะตอมของโลหะกับอะตอมของอโลหะ โดยอะตอมโลหะให้อิเล็กตรอนแก่อะตอมของอโลหะ ยกตัวอย่างเช่น อะตอมโซเดียม (Na) และอะตอมคลอรีน (Cl) กลายเป็นโซเดียมคลอไรด์ (NaCl) หรือเกลือ โซเดียมมีอิเล็กตรอนวงนอกสุด 1 ตัว จึงยกอิเล็กตรอนตัวนี้ให้แก่อะตอมคลอรีน ทำให้อะตอมโซเดียมเองมีประจุเป็นบวก เนื่องจากมีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 1 ตัว ในฝั่งของอะตอมคลอรีนมีอิเล็กตรอนวงนอกสุด 7 ตัว เมื่อได้รับอิเล็กตรอนเข้ามาเพิ่มอีก 1 ตัวทำให้มีจำนวนอิเล็กตรอนมากกว่าโปรตอนในอะตอมของตัวเองอยู่ 1 และทำให้มันมีประจุเป็นลบ
พันธะโคเวเลนต์ (Covalent bond) มาจากคำว่า co + valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของพันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆสารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าสารโคเวเลนต์โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าโมเลกุลโคเวเลนต์
การเกิดพันธะโคเวเลนต์
ดังที่ได้กล่าวไว้แล้วว่าพันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
- ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะเดี่ยวเช่น ในโมเลกุลของไฮโดรเจน
- ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะคู่เช่น ในโมเลกุลของออกซิเจน
- ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสามเช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น
การเขียนสูตรและการเรียกชื่อสารโคเวเลนต์
สูตรเคมี หมายถึงสัญลักษณ์ที่ใช้เพื่อแสดงว่าสารประกอบนั้นมีธาตุอะไรบ้างเป็นองค์ประกอบอย่างละกี่อะตอม สูตรเคมีแบ่งออกเป็น 3 ประเภทคือ
1. สูตรโมเลกุลเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้างอย่างละกี่อะตอม เช่น สูตรโมเลกุลของน้ำตาลกลูโคส คือ C6H12O6แสดงว่ากลูโคสประกอบด้วยธาตุ C , H และ O จำนวน 6 , 12 และ 6 อะตอมตามลำดับ
สำหรับสูตรโมเลกุล ของสารโคเวเลนต์โดยทั่วไป จะเขียนสัญลักษณ์ของธาตุในโมเลกุล เรียงลำดับคือ B , Si, C , P , H , S , I , Sr , Cl , O และ F เช่น ClF OF2, CO2เป็นต้น
2. สูตรอย่างง่ายเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง มีอัตราส่วนของจำนวนอะตอมเป็นเท่าใด เช่น สูตรอย่างง่ายของกลูโคสคือ CH2O ซึ่งแสดงว่ากลูโคสประกอบด้วยธาตุ C, H และ O โดยมีอัตราส่วนอะตอมของ C : H : O = 1: 2 : 1
3. สูตรโครงสร้างเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอมและแต่ละอะตอมยึดเหนี่ยวกันด้วยพันธะเคมีอย่างไร จะเห็นได้ว่าสูตรโครงสร้างของสารให้ราบละเอียดเกี่ยวกับองค์ประกอบของธาตุต่าง ๆ ในโมเลกุลมากกว่าสูตรอย่างง่ายและสูตรโมเลกุล
สูตรโครงสร้างสามารถเขียนได้ 2 แบบ คือ สูตรโครงสร้างแบบจุด (electron dot formula) หรือสูตรโครงสร้างแบบลิวอิส (Lwwis formula) และสูตรโครงสร้างแบบเส้น (graphic formula) สูตรโครงสร้างทั้ง 2 แบบจะแสดงเฉพาะเวเลนต์อิเล็กตรอนของอะตอมคู่ร่วมพันธะ
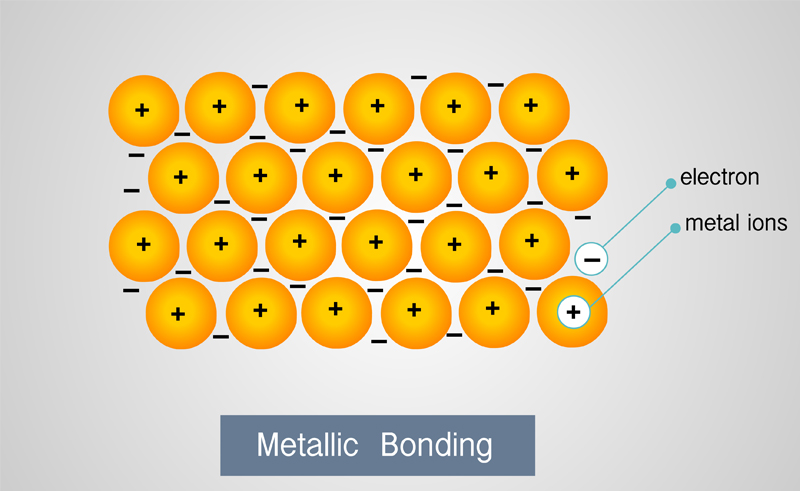
3.4 พันธะโลหะ (Metallic Bond)
เป็นพันธะซึ่งเกิดขึ้นกับอะตอมของธาตุที่เป็นโลหะ เกิดขึ้นเมื่ออะตอมของโลหะแบ่งกันใช้อิเล็กตรอนวงนอกสุดของอะตอม โดยที่อิเล็กตรอนที่แบ่งกันใช้นี้ไม่ได้เป็นส่วนหนึ่งของอะตอมใดอะตอมหนึ่งโดยสมบูรณ์ และนั่นทำให้มีการเคลื่อนที่ของอิเล็กตรอนอยู่ตลอดเวลา ทุก ๆ อะตอมของโลหะจึงอยู่ใกล้กับอะตอมอื่นยาวไปอย่างไม่สิ้นสุด และนั่นทำให้ธาตุโลหะไม่มีสูตรโมเลกุล
ยกตัวอย่างเช่น อะตอมของเหล็ก (Fe) อยู่รวมกันเป็นจำนวนมากจนกลายเป็นแผ่นเหล็กหรือแท่งเหล็กได้ โดยไม่มีการกำหนดตัวเลขจำนวนอะตอมในหนึ่งโมเลกุล และการเคลื่อนที่ได้อย่างอิสระของอิเล็กตรอนนี้เองที่ทำให้โลหะสามารถนำประจุไฟฟ้าได้ดี เพราะอิเล็กตรอนที่ถูกเติมเข้ามาในโลหะสามารถไหลจากจุดหนึ่งไปยังจุดใด ๆ ได้อย่างอิสระ ดังนั้น หากมีแท่งเหล็กและมีการต่อไฟฟ้าเข้าที่จุดใดจุดหนึ่งของแท่งเหล็ก เมื่อคุณจับหรือสัมผัสส่วนใดของแท่งเหล็กก็จะช็อตได้ทั้งสิ้น เช่นเดียวกับการถ่ายโอนความร้อนด้วยการนำความร้อนให้กระจายไปทั่ว การเคลื่อนที่ของอิเล็กตรอนที่เป็นอิสระนี้เองก็ทำให้โลหะมีลักษณะมันวาว เนื่องจากความสามารถในการสะท้อนแสงได้ดี นอกจากนั้นการที่แต่ละอะตอมใช้อิเล็กตรอนวงนอกสุดร่วมกัน ทำให้อะตอมอยู่ใกล้ชิดกันอย่างเหนียวแน่นและนั่นทำให้ธาตุโลหะส่วนใหญ่มีจุดหลอมเหลวสูงอีกด้วย





ไม่มีความคิดเห็น:
แสดงความคิดเห็น